【东大新闻网2月27日电】(通讯员 余家仪)近日,东南大学医学院、教育部“发育与疾病相关基因”重点实验室赵春杰研究团队在Science Advances刊发了题为FOXG1 drives transcriptomic networks to specify principal neuron subtypes during the development of the medial pallium的研究论文(东南大学博士生巴茹、复旦大学博士生杨霖为论文的共同第一作者)。
大脑的古皮质在进化上发生较早,早于新皮质,由海马CA1-CA3、齿状回和海马下托等亚区组成,是行使学习记忆、空间定位以及情绪等脑高级功能的主要脑区;压后皮质位于新皮质和古皮质之间,又被称为中间皮质或移行皮质,在发生上晚于古皮质。压后皮质与其邻近的海马及海马下托等区域存在着紧密的神经投射联结,也是调节情景记忆、空间记忆等功能的重要脑区。古皮质和压后皮质发育异常可导致多种脑高级功能障碍,其中包括自闭症谱系障碍、精神分裂症、癫痫等疾病。但是,目前对于海马CA1-CA3、齿状回、海马下托以及压后皮质各亚区是如何发育特化的,所知甚少。
该研究聚焦调控大脑发育的重要转录因子FOXG1开展研究,前期研究工作表明FOXG1基因突变可引发FOXG1综合征,患者表现出小头畸形、发育迟缓、智力低下、社交退缩行为、刻板动作语言障碍以及癫痫等。该研究通过建立条件性Foxg1基因敲除小鼠,结合单细胞测序、ChIP-qPCR和子宫内胚胎电转等技术,解析了FOXG1调控CA1-CA3、齿状回、海马下托以及压后皮质各亚区不同类型兴奋性投射神经元的特化机制,揭示了古皮质和压后皮质发育的基因转录调控规律,有助于理解学习记忆、空间定向和情绪调节等脑高级功能的生物学基础,加深了人们对FOXG1综合征、自闭症谱系障碍等疾病发病机制的认识,并为研发相关神经精神疾病的早期诊断手段以及发现干预靶点提供了新的线索。

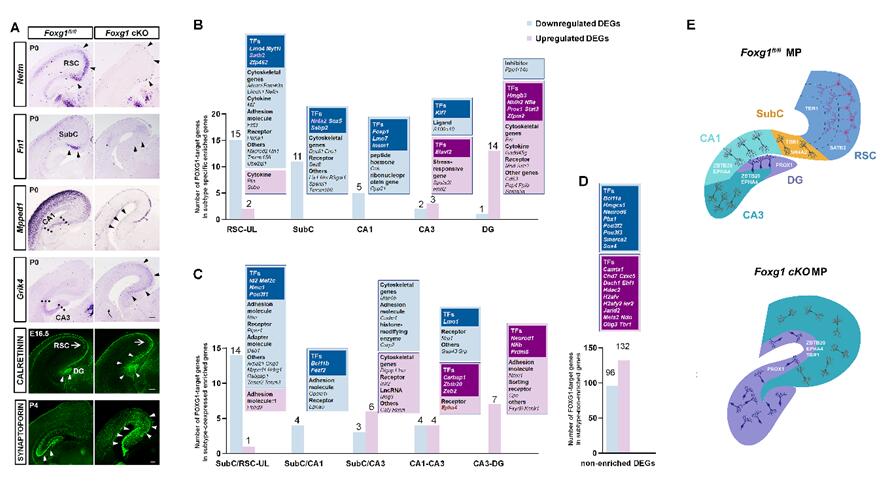
在发育过程中,海马CA1-CA3、齿状回、海马下托以及压后皮质的兴奋性投射神经元均由大脑内侧皮质的神经干细胞增殖而来,细胞离开细胞周期后经过精密而严格的基因时序转录调控进而特化为不同类型的神经元。研究团队利用Nex-Cre和Foxg1fl/fl小鼠在大脑皮质有丝分裂后神经元中敲除Foxg1,通过形态学分析和单细胞测序后的细胞类型鉴定分析,发现敲除Foxg1导致压后皮质和海马下托区域的锥体神经元消失,无法特化;海马下托的邻接区域CA1的锥体神经元丧失了其特异性的分子表达谱,转而呈现CA3的特征,而正常状态下CA1和CA3的锥体神经元虽然在形态结构和功能上具有很高的相似性,但二者又各自具有其独特的分子表达谱。因此在Foxg1敲除小鼠的大脑皮质中,整个古皮质和压后皮质区域被CA3锥体神经元和齿状回颗粒细胞所占据。研究团队通过比较分析野生型和敲除小鼠古皮质和压后皮质各亚区不同类型神经元的基因转录图谱,鉴定了FOXG1下游的靶基因,并在神经元类型特异性表达、两组或者多组类型神经元共表达以及各亚区普遍共表达的基因图谱三个层面解析了FOXG1调控不同类型神经元特化的转录网络。为了进一步在上述三个层面解析和验证FOXG1的调控功能,研究人员利用ChIP-qPCR,免疫荧光素酶实验和子宫内胚胎电转实验方法,发现FOXG1通过直接抑制细胞命运关键决定因子Zbtb20,Prox1和Epha4的转录进而阻遏海马特性、促进压后皮质和海马下托锥体神经元的特化;同时通过转录激活Nr4a2促进海马下托锥体神经元的特性;通过激活Satb2促进压后皮质神经元的特化;在CA1锥体神经元的特化过程中需要FOXG1直接抑制Tbr1的转录。因此,FOXG1作为上游关键因子通过精密地调控不同的基因转录网络决定古皮质和压后皮质不同类型神经元的特化。
该研究得到国家自然科学基金重点项目以及科技部“脑科学与类脑研究”计划等资助,复旦大学脑科学研究院杨振纲教授课题组对此项研究给予了大力支持和帮助。
原文链接:https://www.science.org/doi/10.1126/sciadv.ade2441
供稿:医学院
(责任编辑:吴涵玉 审核:李小男)
























